11月29日,CFDA發(fā)布了2個(gè)文件:一是《關(guān)于進(jìn)一步規(guī)范仿制藥質(zhì)量和療效一致性評價(jià)參比制劑選擇等相關(guān)事宜的指導(dǎo)意見(征求意見稿)》(以下簡稱“參比制劑選擇征求意見稿”),另一個(gè)是《仿制藥質(zhì)量和療效一致性評價(jià)品種分類的指導(dǎo)意見(征求意見稿)》(以下簡稱“一致性評價(jià)品種分類征求意見稿”)。
“參比制劑選擇征求意見稿”四大變化
- 優(yōu)先選擇原產(chǎn)地進(jìn)口作參比制劑 無論該藥品品種是否在國內(nèi)已上市,《參比制劑選擇征求意見稿》明確參比制劑優(yōu)先選擇原研上市許可持有廠家原產(chǎn)地進(jìn)口產(chǎn)品,其次才選擇原研上市許可持有廠家其他產(chǎn)地進(jìn)口產(chǎn)品,但該產(chǎn)品須在歐盟、美國、日本上市,并具有參比制劑地位。
- 原研企業(yè)在中國境內(nèi)生產(chǎn)上市的品種不是都能成為參比制劑 2016年第61號文只要求“若原研企業(yè)能證明其地產(chǎn)化藥品與原研藥品一致,地產(chǎn)化藥品也可作為參比制劑使用”。然而,“參比制劑選擇征求意見稿”對能成為參比制劑的地產(chǎn)化藥品進(jìn)行限制:同一條生產(chǎn)線生產(chǎn)的原研國內(nèi)地產(chǎn)化產(chǎn)品,同時(shí)在歐盟、美國或日本上市的選擇為參比制劑;原研國內(nèi)地產(chǎn)化產(chǎn)品與原研產(chǎn)品處方工藝等均未發(fā)生改變的可以選擇為參比制劑;原研國內(nèi)地產(chǎn)化產(chǎn)品與原研產(chǎn)品處方工藝等有改變,其生產(chǎn)企業(yè)需證明地產(chǎn)化產(chǎn)品與原研產(chǎn)品質(zhì)量與療效一致后選擇為參比制劑。對于原研國內(nèi)地產(chǎn)化產(chǎn)品與原研產(chǎn)品處方工藝等有改變、其生產(chǎn)企業(yè)無法自證一致性的,不能成為參比制劑,需另外確定國外原研藥品參比制劑。
- 改規(guī)格、改劑型、改鹽基的仿制品種的參比制劑仍待后續(xù)文件發(fā)布 “參比制劑選擇征求意見稿”首次提及改規(guī)格、改劑型、改鹽基的仿制品種選擇參比制劑問題,但相關(guān)文件《仿制藥質(zhì)量和療效一致性評價(jià)改規(guī)格藥品評價(jià)一般考慮》、《仿制藥質(zhì)量與療效一致性評價(jià)工作中改劑型藥品(普通口服固體制劑)評價(jià)一般考慮》和《仿制藥質(zhì)量和療效一致性評價(jià)工作中改鹽基藥品評價(jià)一般考慮》仍待發(fā)布。
- 參比制劑的獲得途徑新添兩種途徑 除了2016年第61號文所提及的“企業(yè)自主購買”,并辦理一次性進(jìn)口的參比制劑的獲得途徑外,“參比制劑選擇征求意見稿”首次提及“委托第三方購買”和“協(xié)助企業(yè)購買”兩種參比制劑的獲得途徑。“委托第三方購買”鼓勵擁有進(jìn)出口資質(zhì)的第三方貿(mào)易公司提供參比制劑采購服務(wù),這將利好相關(guān)的進(jìn)口業(yè)務(wù)。“協(xié)助企業(yè)購買”將有望協(xié)助企業(yè)解決“特殊品種、通過市場途徑無法購買的品種”難以購買參比制劑的難題。
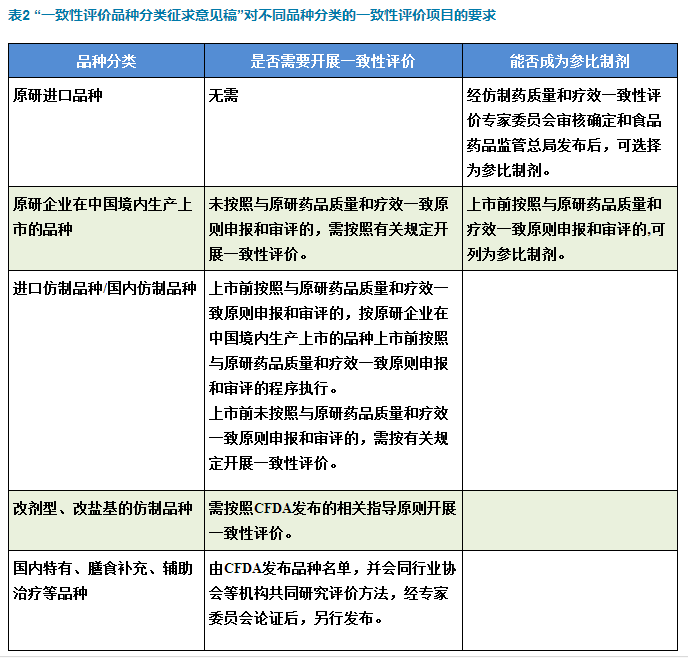
“一致性評價(jià)品種分類征求意見稿”中的新流程
1、“一致性評價(jià)品種分類征求意見稿”主要針對需要進(jìn)行一致性評價(jià)的基藥289品種的分類再進(jìn)一步指導(dǎo)。
2、“一致性評價(jià)品種分類征求意見稿”所影響的范圍可能不限于289品種。對于原研企業(yè)在中國境內(nèi)生產(chǎn)上市的品種而言,證明原研國內(nèi)地產(chǎn)化產(chǎn)品與原研藥品質(zhì)量和療效一致的程序需要參考“一致性評價(jià)品種分類征求意見稿”。
3、“一致性評價(jià)品種分類征求意見稿”首先提出國內(nèi)特有、膳食補(bǔ)充、輔助治療等品種未來也需要進(jìn)行評價(jià),但方法仍待發(fā)布。
?